近日,来自美国Texas A&M University Health Science Center的宋建勋团队/University of Kentucky Markey Cancer Center的杨金铭团队/Columbia University Irving Medical Center的王建龙团队合作在Science Advance 发表了题为NAC1 modulates autoimmunity by suppressing regulatory T cell–mediated tolerance的研究,发现Treg细胞通过NAC1依赖的乙酰化调节FoxP3蛋白的稳定性从而抑制Treg细胞的功能。异常的自身免疫平衡可导致80多种不同的自身免疫性疾病,其中多种疾病危及患者生命但尚无有效的治疗方式。基于宋/杨/王合作研究团队先前在肿瘤细胞及胚胎干细胞中关于NAC1的表关遗传调控功能的研究和Treg代谢的相关研究结果,作者猜想NAC1 (nucleus accumbens–associated protein-1) 可能是调节Treg细胞介导的免疫抑制的关键因子。与正常小鼠相比,作者观察到在NAC1缺陷小鼠中,Treg细胞的比例和数目都显著上升,那么NAC1缺陷小鼠中的Treg细胞的功能是否与正常Treg具有差异?作者发现,NAC1-/- Treg 中的FoxP3蛋白表达显著升高。由于此前报道NAC1参与细胞代谢调节,因此作者进一步研究了NAC1-/- Treg细胞与正常Treg细胞的代谢差异,以及相关的功能分析。研究发现,NAC1 -/- Treg 细胞的线粒体呼吸速率和糖酵解速率都发生显著上升。不仅如此,NAC1-/- Treg的TGF-β,IL-10的分泌的显著升高和对CD4+ T细胞的增殖抑制都表明其更强的免疫抑制功能。为了确定NAC1 -/- Treg 细胞在体内的功能,作者利用小鼠构建了结肠炎模型,风湿性关节炎模型。在结肠炎模型中,作者发现NAC1缺陷小鼠的小肠指装绒毛结构病变程度减弱,体重下降程度较为轻微并且生存率更高。在关节炎模型中,分析显示NAC1缺陷小鼠的关节炎症和红肿程度显著减轻。这些体内结果阐明NAC1 -/- Treg介导的免疫抑制增强了小鼠对自身免疫性疾病的耐受。为了进一步确定NAC1调节Treg细胞功能的机制,作者首先尝试分析了FoxP3 基因启动子区域的甲基化水平在正常Treg和NAC1/-/ Treg间的差异,分析结果显示与正常的Treg细胞相比,NAC1-/- Treg在甲基化水平对FoxP3 基因启动子调节无明显差异,RNA-seq分析,CHIP-seq分析和ATAC-seq分析也表明NAC1对FoxP3的转录水平无法直接调节。但是作者发现,随着正常naïve CD4+ T细胞向iTreg分化,其NAC1表达逐渐降低并且FoxP3逐渐升高,并且由于NAC1并不参与FoxP3基因启动子甲基化和转录组调节,这提示NAC1很大程度上可能参与了FoxP3基因转录后调节。基于合作团队先前对NAC1在肿瘤及干细胞中表关遗传调控功能的研究及已知FoxP3蛋白在T细胞中的翻译后修饰调节其稳定性, 合作团队提出NAC1可能会通过HDAC互作蛋白调节FoxP3蛋白的乙酰化水平的假设。为了验证猜想,作者利用过表达NAC1发现,NAC1负性调节Treg细胞中FoxP3表达并且通过HDAC9抑制FoxP3蛋白的乙酰化水平导致其稳定性降低,从而实现对Treg功能的抑制。
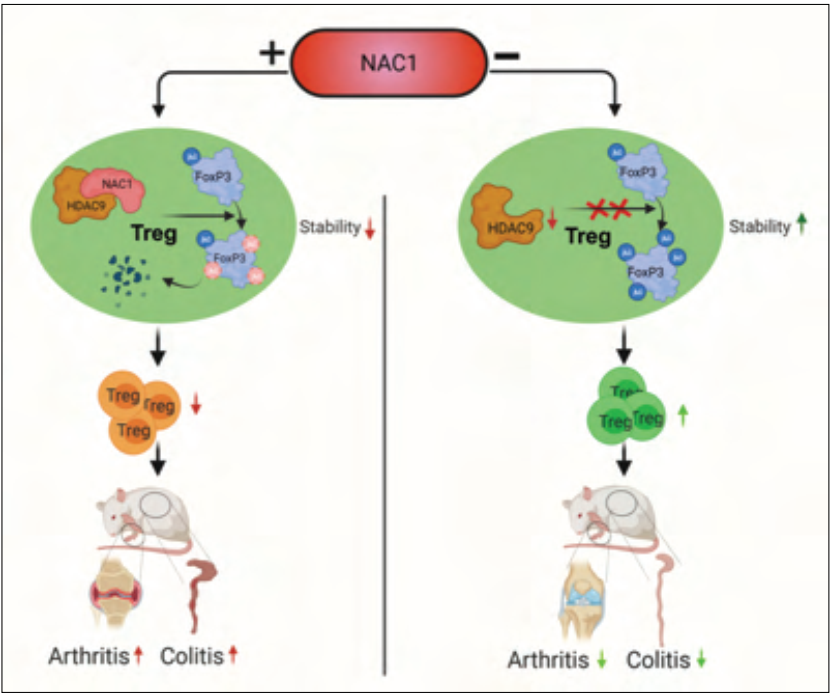
总结来说,这项研究揭示NAC1缺失增强了Treg细胞中管家蛋白FoxP3蛋白的乙酰化介导的稳定性,从而改善了小鼠对自身免疫性疾病的耐受。这为通过干预Treg中NAC1表达治疗自身免疫疾病提出了新策略。本文共同第一作者为杨金铭教授,任忆捷博士和Anil Kumar博士后,通讯作者为杨金铭教授,宋建勋教授和王建龙教授。https://www.science.org/doi/10.1126/sciadv.abo0183



